Protocollo per processamento della biopsia renale per microscopia ottica.
- All'arrivo del campione, dopo valutazione dell'adeguatezza ed eventuale divisione per le diverse tecniche di studio, il materiale destinato alla microscopia ottica viene posto a fissare in formalina neutra tamponata (NBF) al 10% per circa 30-60 min (non più di 24h).
- Una volta fissato, il materiale bioptico viene posto in una biocassetta con identificativo univoco del paziente associato a barcode.
- La biocassetta contenente il materiale è inserita all'interno del processatore automatico, che espone il campione a scale ascendenti di alcohol (70%, 95% e aclohol assoluto) con esposizione finale allo xilene, con tempi impostati automaticamente dal processatore. Alternativamente, in assenza di processatore automatico il campione viene sottoposto manualmente a scala di alcoli come segue:
- DISIDRATAZIONE
- Alcool 50º 30' per frustoli renali
- Alcool 70º 30'per frustoli renali
- Alcool 95º 20'per frustoli renali
- Alcool 95º 20'per frustoli renali
- Alcool 100º 20'per frustoli renali
- Alcool 100º 20'per frustoli renali
- CHIARIFICAZIONE
- Xileneº 20' per frustoli renali
- Finito il ciclo di processazione, il tessuto è infiltrato dalla paraffina (1h 30’) ed incluso in un blocchetto con lo stesso identificativo presente sulla biocassetta.
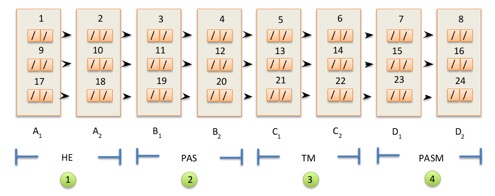
- Una volta pronto, il blocchetto è sottoposto al taglio mediante microtomo per ottenere sezioni (spessore 2-3 micron) da dedicare alle colorazioni Ematossilina Eosina, impregnazione argentica sec. Jones, Acido periodico di Schiff (PAS) e Tricromica di Masson, come illustrato nella Figura 1. Nella fattispecie, i vetrini designati come A2, B2, C2 e D2 saranno destinati alla rivalutazione (peer review) centralizzata per lo studio CLIgAN.
- Nel dettaglio, il protocollo utilizzato prevede l'ottenimento di sezioni consecutive del tessuto poste su vetrino N.1 partendo dalla regione più vicina all'etichetta con numerazione progressiva dei vetrini che segua l'andamento discendente dei livelli di tessuto, come illustrato nella Figura 1. In presenza di una ridotta quantità di tessuto renale si possono apporre solo due sezioni per vetrino.
- Tra una fila e la successiva due sezioni vengono conservate su vetrino carico per eventuali colorazioni aggiuntive o immunoistochimiche. In caso il frustolo per immunofluorescenza (inviato a fresco) non sia pervenuto al laboratorio o sia inadeguato per assenza di glomeruli, ove possibile, si eseguono 8 aggiuntive sezioni "in bianco" su vetrino polilisinato carico tra una fila e la successiva per esecuzione di immunofluorescenza da materiale paraffinato.
- A seguito della fase di taglio, i vetrini ottenuti vengono sottoposti a sparaffinatura come segue:
- SPARAFFINATURA e IDRATAZIONE
- Xilene 4'
- Alcool 100º 2'
- Alcool 95º 2'
- Alcool 70º 2'
- Alcool 50º 2'
- Lavaggio in acqua dist.

Protocollo per la colorazione dei preparati per microscopia ottica.
- Ematossilina ed Eosina con coloratore automatico
- Ematossilina ed Eosina - protocollo manuale
- Vetrini già sparaffinati e in acqua dist.
- Ematossilina: 4'Immergere i vetrini nel colorante
- Scaricare sotto acqua di fonte
- Alcool- Acido: Gocciolare con contagocce su vetrino (recuperando nella soluzione "madre")
- Tamponare immediatamente in acqua dist.
- Lavaggio veloce in acqua dist.
- Eosina: 5' Immergere i vetrini nel colorante
- Lavaggio veloce in acqua dist.
- Disidratare e montare
- Alcool 95º 1'
- Alcool 100º 2'
- Xilene 5'
- Montare i vetrini con Eukitt
- Ematossilina: Emallume di Mayer (Bio-Optica)
- Eosina (0.5%): 0.5 gr Eosina in 100 ml di soluzione aggiungere 0.5 ml di acido acetico glaciale
- Alcool- acido : 100 ml Alcool 70% + 0.5 ml HCl conc. 37%
Per l'Ematossilina Eosina (EE) viene utilizzato il coloratore automatico Tissue-Tek Prisma con montatore automatico di vetrini Tissue-Tek Film Coverslipper (Sakura). Nello strumento sono presenti 24 vaschette dalla capacità di 650 ml contenenti quanto segue:

Lo strumento viene avviato, il cestello contenente i vetrini di biopsia renale viene posto in una delle tre vaschette di ingresso, viene selezionato il programma di colorazione e al termine del processo il cestello viene spostato nello scompartimento montavetrini per l'applicazione automatica del film.
Colorazione: blu scuro i nuclei, rosa chiaro il citoplasma . Studio degli infiltrati infiammatori, del citoplasma tubulare e dei depositi fibrinoidi glomerulari.
Soluzioni:
Protocollo per la colorazione dei preparati per microscopia ottica.
- Impregnazione argentica sec. Jones
- Portare le sezioni all' acqua distillata.
- Porre 10 gocce del reattivo A sulla sezione: lasciare agire 30 minuti.
- Lavare in acqua distillata.
- Allestire la camera umida e porre il vetrino con la sezione rivolta verso l'alto. Versare nella capsula piccola annessa alla confezione 10 gocce del reattivo B, aggiungere 10 gocce del reattivo C e 10 gocce del reattivo D, agitare e porre la soluzione così ottenuta sulla sezione: chiudere la camera umida ed incubare in stufa a 60º C. Lasciare agire 30-40 minuti.
- Estrarre la camera umida dalla stufa, aprire il coperchio e controllare il tono dell'impregnazione: se l'annerimento è corretto, lasciare raffreddare il vetrino per 5 minuti e lavarlo in acqua distillata; se è insufficiente, incubare di nuovo in stufa e controllare ogni 5 minuti.
- Porre 10 gocce del reattivo E sulla sezione: lasciare agire 1 minuto.
- Lavare in acqua distillata.
- Porre 10 gocce del reattivo F sulla sezione: lasciare agire 1 minuto.
- Lavare in acqua distillata
- Disidratare attraverso la serie ascendente degli alcol, xilene e balsamo.
- Al termine della colorazione, la sezione viene controcolorata con Ematossilina Eosina all'interno del coloratore automatico per circa 30 minuti.
- Acido periodico soluzione 30 ml
- Argento nitrato soluzione 30 ml
- Esametilentetramina soluzione 30 ml
- Sodio tetraborato soluzione 30 ml
- Oro cloruro soluzione 30 ml
- Soluzione di fissaggio 30 ml
- Impregnazione argentica sec. Jones (protocollo senza kit BioOptica)
- Vetrini già sparaffinati e in acqua dist.
- Acido Periodico (1%) ................................ 25' Immergere i vetrini
- Lavaggio veloce in acqua dist.
- Working Xexamine silver solution ..................... 1h Immergere i vetrini (controllare al microscopio ogni 2 minuti )
- Lavaggio veloce in acqua dist.
- Cloruro d'oro (0.2%) ................................ differenziare in 2-3 passaggi
- Lavaggio veloce in acqua dist.
- Sodio tiosolfato (2%) ................................ 1' Immergere i vetrini
- Bouin ................................ a 60ºC per 30'oppure over night a temp.amb. Immergere i vetrini
- Lavaggio veloce in acqua di fonte: finchè tutte le sezioni siano bianche
- Lavaggio veloce in acqua dist.
- Ac. Fosfotungstico (1%) ................................ 1'-2' Immergere i vetrini
- Lavaggio veloce in acqua dist.
- Chromotrope 2R ................................ 15' Immergere i vetrini
- Lavaggio veloce in acqua dist.
- Disidratare e montare.
- Acido Periodico di Schiff (PAS)
- Portare la sezione all'acqua distillata.
- Porre 10 gocce del reagente A sulla sezione: lasciare agire 10 minuti.
- Lavare in acqua distillata.
- Porre 10 gocce del reagente B sulla sezione: lasciare agire 20 minuti.
- Lavare in acqua distillata.
- Porre 10 gocce della soluzione C sulla sezione: lasciare agire 2 minuti.
- Sgocciolare il vetrino e, senza lavare, porre sulla sezione 10 gocce del reagente D: lasciare agire 2 minuti.
- Lavare in acqua distillata.
- Porre sulla sezione 10 gocce del reagente E: lasciare agire 3 minuti.
- Far virare in acqua corrente di fonte per 5 minuti.
- Disidratare nella serie ascendente degli alcol, xilene e balsamo
- Acido periodico soluzione 30 ml
- Reattivo di Schiff 30 ml
- Potassio metabisolfito soluzione 30 ml
- Emallume di Mayer 30 ml
- Acido Periodico di Schiff (PAS) senza kit BioOptica
- Vetrini già sparaffinati e in acqua dist.
- Acido Periodico (1%) ................................ 4' Immergere i vetrini /li>
- Lavaggio veloce in acqua di fonte
- 2 Lavaggi veloci in acqua dist.
- Reattivo di Shiff ................................ 25' Immergere i vetrini
- Lavaggio veloce in acqua di fonte; sciacquare fino a quando l'acqua non sarà trasparente
- Lavaggio veloce in acqua dist.
- Ematossilina ................................ 5' Immergere i vetrini
- Lavaggio veloce in acqua di fonte ; sciacquare fino a quando l' acqua non sarià trasparente
- Lavaggio veloce in acqua dist.
- Alcool - Acido: ................................ Gocciolare con contagocce su vetrino (recuperando nella soluzione "madre")
- Tamponare immediatamente in acqua dist.
- Lavaggio veloce in acqua dist.
- Disidratare e montare
- Alcool 95º ................................ 1'
- Alcool 100º .............................. 2'
- Xilene .............................. 5'
- Montare i vetrini con Eukitt
- Acido periodico (1%) = 1ml in 100 ml di acqua dist.
- Reattivo di Shiff : pronto Bio-Optica (conservato in camera fredda +4ºC)
- Tricromica sec. Masson
- Portare la sezione all' acqua distillata.
- Porre sulla sezione 6 gocce del reagente A, aggiungervi 6 gocce del reagente B: lasciare agire 10 minuti.
- Senza lavare, sgocciolare il vetrino e porre sulla sezione 10 gocce della soluzione C: lasciare agire 4 minuti.
- Lavare rapidamente (3-4 secondi) in acqua distillata e porre sul vetrino 10 gocce della soluzione D: lasciare agire 4 minuti.
- Lavare in acqua distillata e porre sulla sezione 10 gocce della soluzione E: lasciare agire 10 minuti.
- Senza lavare, sgocciolare il vetrino e porvi 10 gocce della soluzione F: lasciare agire 5 minuti.
- Lavare in acqua distillata e disidratare rapidamente attraverso la serie ascendente degli alcol, lasciando 1 minuto nell' ultimo assoluto: xilene e balsamo.
- Ematossilina ferrica secondo Weigert, soluzione A 18 ml
- Ematossilina ferrica secondo Weigert, soluzione B 18 ml
- Acido picrico soluzione alcolica stabilizzata 30 ml
- Ponceau B soluzione 30 ml
- Acido fosfomolibdico soluzione stabilizzata 30 ml
- Verde luce secondo Goldner 30 ml
- Tricromica sec. Masson senza kit BioOptica
- Vetrini già sparaffinati e in acqua dist.
- Fissare nuovamente in BOUIN ................................ 1-2h a 60ºC e/o tutta la notte a temp.amb.
- Lavaggio veloce in acqua di fonte; finchè tutte le sezioni siano bianche
- Lavaggio veloce in acqua dist.
- Ematossilina ferrica di Weigert ................................ 5-6'
- Scaricare nella scatola Kartell
- Lavaggio veloce in acqua dist.
- 10 gocce di acido picrico soluzione stabilizzata alcolica
- Lavaggio veloce in acqua dist.
- Ponceau fucsina ................................ 15' Immergere i vetrini
- 10 gocce di Acido Fosfomolibdico (2%).
- Sgocciolare il vetrino senza lavarlo.
- Verde Luce (2%) ................................ 2-3' Immergere i vetrini
- Lavaggio in H2dO
- Disidratare e montare (passare immediatamente nell'alcool 95º)
- Alcool 100º .............................. 2'
- Xilene .............................. 5'
- Montare i vetrini con Eukitt
- Acido Picrico in soluzione alcolica .............................. 15 ml /50 ml.
- Formaldeide .............................. 6 ml /20 ml.
- Acido Acetico Glaciale .............................. 1.5 ml /5 ml.
- Acido Picrico in soluzione alcolica: Alcool 95º .............................. 758 ml.
- Acqua dist .............................. 142 ml.
Per eseguire la colorazione sec. Jones si utilizza il protocollo modificato del kit fornito da Bio- Optica (n° 04-043822). Nel dettaglio, il metodo prevede quanto segue:
Metodo
Reattivi
Protocollo per la colorazione dei preparati per microscopia ottica.
Per eseguire la colorazione PAS si utilizza il protocollo modificato del kit fornito da Bio-Optica (nº04-130802). Nel dettaglio, il metodo prevede quanto segue:
Metodo
Reattivi
Colorazione:
blu scuro i nuclei, rosa tenue i citoplasmi, rosso porpora le membrane basali, la matrice mesangiale e la sostanza ialina. Studio delle membrane basali glomerulari e tubulari e della matrice mesangiale per evidenziare la sclerosi glomerulare, la ialinosi arteriolare e le goccioline da riassorbimento proteico nelle cellule dell'epitelio glomerulare e tubulare.
Soluzioni:
Protocollo per la colorazione dei preparati per microscopia ottica.
Per eseguire la colorazione Tricromica si utilizza il protocollo modificato del kit fornito da Bio- Optica (nº 04-011802). Nel dettaglio, il metodo prevede quanto segue:
Metodo
Reattivi
Colorazione:
blu scuro i nuclei , rosa il citoplasma, verde il connettivo e l'interstizio. Studio dei glomeruli, tubuli ,spazio interstiziale e membrane basali ed è specifica per il connettivo. Fornisce informazioni sulla presenza di infiltrati infiammatori e di aree di fibrosi interstiziale.
Soluzioni:
Bouin :